界面新闻记者 |
界面新闻编辑 | 谢欣
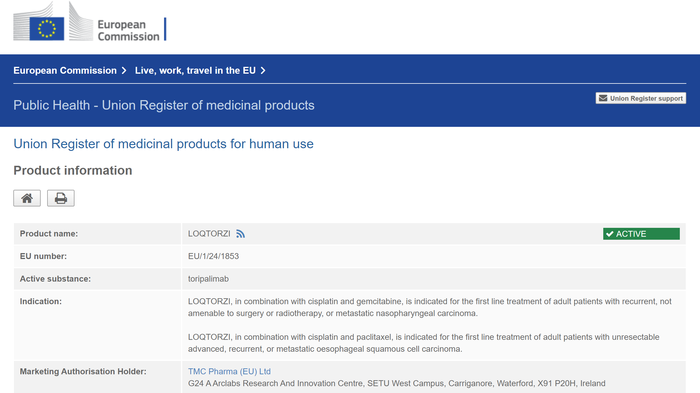
当地时间9月23日,据欧盟官方网站,君实生物的特瑞普利单抗(欧洲商品名:LOQTORZI®)已获批。
欧盟官网显示,特瑞普利单抗此次获批有两项适应症:一是与顺铂和吉西他滨联用,适用于复发性、不适合手术或放疗的、或转移性鼻咽癌的成人患者的一线治疗;二是,与顺铂和紫杉醇联用,适用于不能切除的晚期、复发或转移性食管鳞状细胞癌成年患者的一线治疗。
由此,特瑞普利单抗成为欧洲首个且唯一用于鼻咽癌治疗的PD-1,也是欧洲唯一用于不限PD-L1表达的晚期或转移性食管鳞癌一线治疗药物。此前,特瑞普利单抗已经在中美获批。
在此前的7月28日,君实生物就已公告,特瑞普利单抗的上市许可申请获得欧洲药品管理局人用药品委员会(CHMP)的积极意见,建议批准其用于治疗前述两项适应症。
特瑞普利单抗注射液(中国商品名:拓益®)是国内批准上市的首个国产PD-1单抗药物。即,2018年12月,国家药品监督管理局有条件批准特瑞普利单抗上市,用于治疗既往接受全身系统治疗失败的不可切除或转移性黑色素瘤。
截至目前,特瑞普利单抗已在中国获批7项适应症,涵盖黑色素瘤治疗、鼻咽癌治疗、尿路上皮癌治疗、食管鳞癌治疗、非鳞状非小细胞肺癌治疗、非小细胞肺癌治疗。2020年12月,特瑞普利单抗首次通过国家医保谈判,目前已有6项获批适应症纳入国家医保目录,且是目录中唯一用于治疗黑色素瘤的抗PD-1单抗药物。
特瑞普利单抗是国产生物创新药积极出海的典型。2023年10月底,特瑞普利单抗(美国商品名:LOQTORZI™)被美国食品药品监督管理局(FDA)批准,作为首款鼻咽癌药物在美国上市。并且,特瑞普利单抗也是FDA批准上市的首个来自中国的生物创新药。
目前,除了鼻咽癌适应症,特瑞普利单抗在黏膜黑色素瘤、软组织肉瘤、食管癌、小细胞肺癌领域获得美国食品药品监督管理局(FDA)授予2项突破性疗法认定、1项快速通道认定、1项优先审评认定和5项孤儿药资格认定。
除了美国,特瑞普利单抗的出海范围还包括欧洲和澳大利亚。在2022年12月和2023年2月,欧洲药品管理局(EMA)和英国药品和保健品管理局(MHRA)分别受理了特瑞普利单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗以及联合紫杉醇和顺铂用于不可切除局部晚期/复发或转移性食管鳞癌患者的一线治疗的上市许可申请(MAA)。
2023年11月,澳大利亚药品管理局(TGA)受理了特瑞普利单抗联合顺铂/吉西他滨作为转移性或复发性局部晚期鼻咽癌成人患者的一线治疗,以及作为单药治疗既往含铂治疗过程中或治疗后疾病进展的复发性、不可切除或转移性鼻咽癌的成人患者的上市许可申请,特瑞普利单抗治疗鼻咽癌获得TGA授予孤儿药资格认定。
迄今为止,特瑞普利单抗已在全球(包括中国、美国、东南亚及欧洲等地)开展了覆盖超过15个适应症的40多项由公司发起的临床研究,正在进行或已完成关键注册临床的适应症包括:肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、肾癌及皮肤癌等。
商业化成绩方面,据君实生物中报,今年上半年,企业实现营收7.86亿元,同比增长17.37%,其中核心产品特瑞普利单抗于国内市场实现销售收入6.71亿元,同比增长约50%。不过,PD-(L)1单抗药物产品也是国内药物同质化的代表类别,国内目前累计获批的PD-(L)1单抗数量已达到20款。
当前,君实生物的商业化产品还有阿达木单抗(君迈康®),它由君实生物与迈威生物合作开发,是君实生物第三款商业化产品。其于2022年3月首次获批上市,截至目前已获批用于类风湿关节炎、强直性脊柱炎、银屑病、克罗恩病、葡萄膜炎、多关节型幼年特发性关节炎、儿童斑块状银屑病、儿童克罗恩病共8项适应症。
特瑞普利单抗的出海也反映了国内正在发生的药品出海大潮。近些年,国内实现中美欧市场上市的药物还包括复星医药旗下的国产曲妥珠单抗汉曲优®(美国商品名:HERCESSI™,欧洲商品名:Zercepac®),它是首个在中、美、欧三大药品市场同时获批的单克隆抗体生物类似药,且产品累计在47个国家和地区获批上市。
另外,百济神州核心产品BTK抑制剂泽布替尼(中文商品名:百悦泽®,英文商品名BRUKINSA®))和PD-1单抗替雷利珠单抗(中文商品名:百泽安®,英文商品名:TEVIMBRA®))也是三地上市产品。







 京公网安备11000000000001号
京公网安备11000000000001号 京ICP备11000001号
京ICP备11000001号